元素周期表是化学中用于表示元素周期律的表格。它按照元素的原子序数从1到118排列,包括7个主族和7个副族,以及第Ⅷ族和第0族。元素周期表分区是根据元素的电子排布和性质将元素分为不同的区域。短周期元素包括氢、氦、碳、氮、氧、氟、钠、镁、铝、硅、硫、氯、氩等,长周期元素包括钾、钙、钪、钛、钒、铬、锰等。还有过渡元素和镧系、锕系元素等。元素周期表分区有助于我们理解和预测元素的性质和应用。
本文目录导读:
元素周期表是化学中非常重要的一个工具,它按照元素的原子序数将元素进行了排序,在这个周期表中,元素被分为了不同的分区,每个分区对应着不同的电子排布和性质,下面我们来详细了解一下元素周期表的分区。
周期表的基本结构
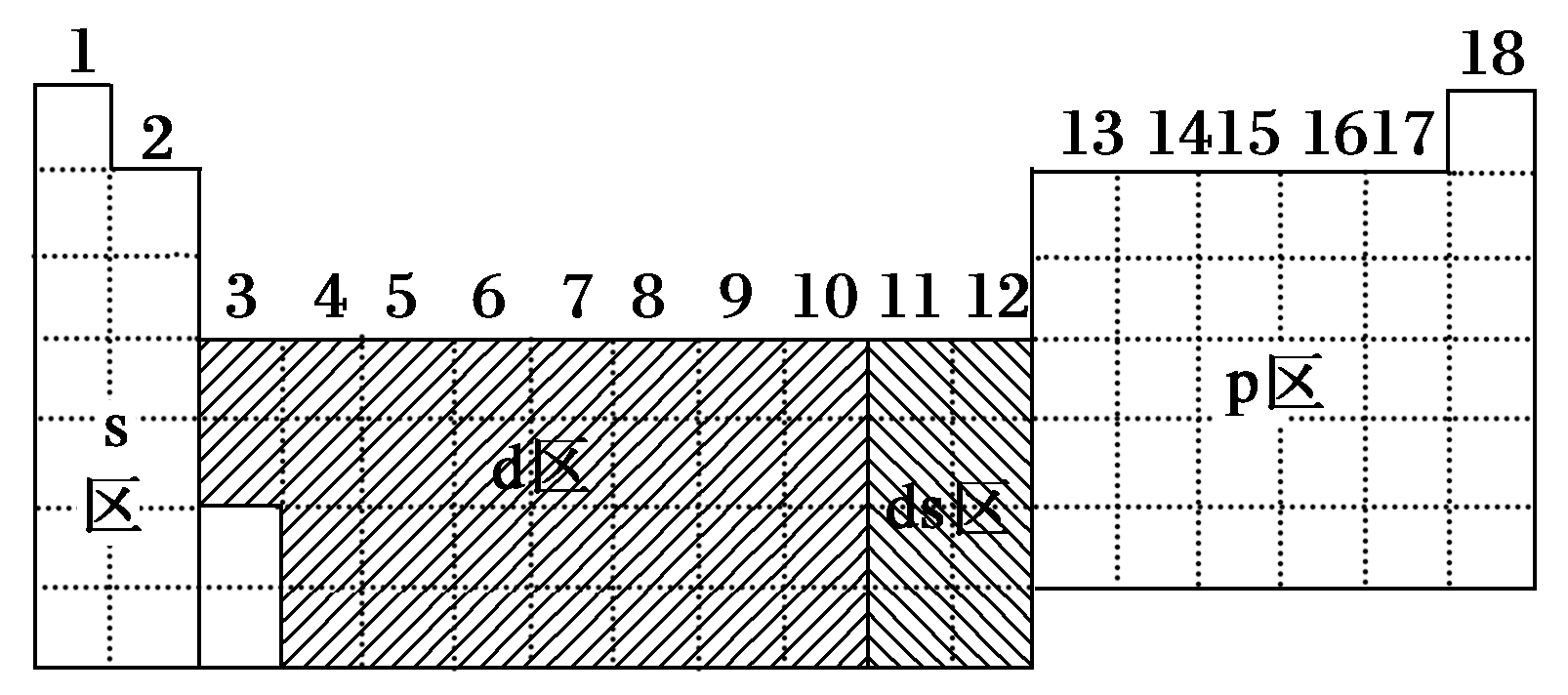
元素周期表按照元素的原子序数递增的顺序排列,从氢(H)开始,一直到鈵(Og),共有118个元素,这些元素被分为了7个横行,即7个周期,每个周期的元素电子排布不同,元素还被分为了18个纵列,即18个族,每个族的元素具有相似的电子排布和性质。
周期表的分区
根据元素的电子排布和性质,元素周期表可以分为以下几个分区:
1、s区:包括IA和IIA族元素,这些元素的原子序数从1到36,它们的外层电子排布为ns^1或ns^2,其中n为1到6的整数,s区的元素通常具有较低的熔点和沸点,以及较好的导电性。
2、p区:包括IIIA到VIIA族元素,原子序数从37到96,它们的外层电子排布为np^1到np^5,其中n为3到6的整数,p区的元素通常具有较高的熔点和沸点,以及较差的导电性。
3、d区:包括VIII族和IB到VIB族元素,原子序数从97到120,它们的外层电子排布为nd^1到nd^10,其中n为4到6的整数,d区的元素通常具有较低的熔点和沸点,以及较好的导电性。
4、f区:包括镧系和锕系元素,原子序数从121到138,它们的外层电子排布为nf^1到nf^14,其中n为6到7的整数,f区的元素通常具有较低的熔点和沸点,以及较好的导电性。
5、内过渡金属区:包括镧系和锕系元素以及它们的相邻元素,原子序数从121到142,这些元素的外层电子排布为nd^1到nd^10或nf^1到nf^14,其中n为4到7的整数,内过渡金属区的元素通常具有较低的熔点和沸点,以及较好的导电性。
6、后过渡金属区:包括IB到VIB族元素以及它们的相邻元素,原子序数从97到120,这些元素的外层电子排布为nd^1到nd^10,其中n为4到6的整数,后过渡金属区的元素通常具有较低的熔点和沸点,以及较好的导电性。
周期表分区的意义
周期表的分区对于化学学习和研究具有重要意义,通过分区,我们可以了解不同区域的元素在电子排布、性质和应用方面的差异,s区的元素通常用于制造轻质金属和半导体材料;p区的元素常用于制造高温耐火材料和高强度合金;d区和f区的元素则常用于制造催化剂和磁性材料,周期表的分区还有助于我们预测新元素的性质和用途。
元素周期表分区是化学学习和研究的重要基础,通过深入了解不同分区的元素在电子排布和性质方面的差异,我们可以更好地理解和应用这些元素在各种领域中的作用。


 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号